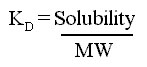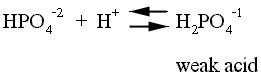ตามปกติอากาศที่เราใช้หายใจนั้นจะประกอบด้วย
nitrogen gas, oxygen gas , carbondioxide gas และ water vapour คนจะหายใจผ่านเข้าทางรูจมูก
หรือ ช่องปากแล้วผ่าน
ลงสู่หลอดลม เข้าสู่ถุงลมปอด โดยอากาศที่ใช้หายใจซึ่งประกอบด้วย
N2, O2 CO2, H2O (water
vapour) นั้น เมื่อเข้าสู่ระบบหายใจจะมีความชื้นมากขึ้น ส่วนปริมาณและความดันของก๊าซแต่ละ
ชนิดจะมีการเปลี่ยนแปลงอย่างชัดเจนเมื่อก๊าซเข้ามาในถุงลม
(ซึ่งเป็นบริเวณที่มีการแลกเปลี่ยน
ก๊าซ) อากาศที่หายใจออกก็จะเป็นอากาศที่ผสมกันระหว่างอากาศจากถุงลม
กับอากาศที่อยู่ใน
ส่วนของ anatomical dead space เฉลี่ยแล้วในการหายใจแต่ละครั้ง
จะมีอากาศจากภายนอก
เข้าไปในส่วนของถุงลมประมาณ 1/8 เท่านั้น
ผนังของถุงลมบางแห่งนั้น epithelial
basement membrane จะ fuse รวมกับ capllary
basement membrane โดยไม่มีชั้นของ interstitial space
ความหนา ของผนังถุงลมบางแห่ง
จะหนาเพียง 0.2 ไมครอน แต่โดยทั่วไปจะมีความหนาเฉลี่ยประมาณ
0.6 ไมครอน ทั้งนี้ถุงลม
ทั้งหมดมีพื้นที่ผิวโดยรวม 50 - 100 ตารางเมตร
การแพร่ผ่านของอากาศผ่าน respiratory
membrane ซึ่งก็คือ ผนังของถุงลม จะเกิดได้ที่ถงุลมซึ่งมีความหนาประมาณ
0.6 ไมครอน ทั้งนี้
เห็นได้ว่าหากเกิดพยาธิสภาพขึ้นที่บริเวณผนังถุงลมปอด มีผนังหนาขึ้น
มีพื้นที่ผิวลดลงก็ย่อม
ทำให้การแพร่ผ่านของอากาศเกิดขึ้นได้ลดลง
การแพร่ผ่านนี้สามารถอธิบายได้ด้วยหลักการ
ทางฟิสิกส์ของ gas เบื้องต้น ตามกฎการแพร่ (diffusion law)
ปัจจัยที่เกี่ยวกับการแพร่ของก๊าซผ่านผนังถุงลม
จะขึ้นกับความหนาของชั้น respiratory membrane นั้นมีหลายอย่าง
ดังที่กล่าวแล้วบางสภาวะที่จะทำให้ผนังของถุงลมมีความหนา
มากขึ้น เช่นภาวะที่มีของเหลวคั่งในชั้น interstitial ก็จะมีผลทำให้อัตราการแพร่ผ่านช้าลงหรือมี
โรคปอดบางชนิดทำให้มี fibrosis บริเวณ respiratory
membrane บางส่วนก็จะมีผลขัดขวาง
การแพร่ผ่านของก๊าซ เป็นต้น นอกจากนี้ยังขึ้นกับ Surface area of
the membrane ประมาณ
ว่าในปอดของคนปกติจะมีพื้นที่ผิวของผนังถุงลม ประมาณ 50-100 ตารางเมตร
เมื่อเทียบกับ
ปริมาณเลือดที่อยู่ในหลอดเลือด capillaries บริเวณถุงลม ซึ่งมีประมาณ
60-140 ml จะเห็นว่า
ปอดมีพื้นที่ในการแลกเปลี่ยนก๊าซระหว่างอากาศกับเลือดสูงมาก ดังนั้นในคนปกติถึงแม้พื้นที่ผิว
ในการแลกเปลี่ยนก๊าซลดลงไปเหลือเพียง 50 % ก็ยังจะไม่พบความผิดปกติของการหายใจใน
ขณะพัก ในทางตรงกันข้าม ถ้าเป็นนักกีฬาที่มีการแข่งขัน ซึ่งร่างกายมีความต้องการใช้
O2 และ
กำจัด CO2 สูงมากการที่มีพื้นที่ผิวลดลงแต่เพียงเล็กน้อยก็จะส่งผลถึงประสิทธิภาพ
ในการ
แข่งขันได้
อัตราการแพร่ของก๊าซแต่ละชนิดผ่านเยื่อผนังถุงลม หาได้จากสูตร

D = diffusion rate ของก๊าซนั้นๆ
P = ค่าต่างของความดันของก๊าซระหว่าง alveoli
กับหลอดเลือด capillary
A = พื้นที่ผิวในการแพร่ผ่านของก๊าซ
d = ความหนาของชั้นผนังเยื่อบุถุงลม
KD= diffusion coefficient ของก๊าซนั้นๆ เมื่อผ่านเยื่อถุงลม |
ค่าสัมประสิทธิ์ของการแพร่ของก๊าซ
(KD) จะแปรผันโดยตรงกับความสามารถในการ
ละลายของก๊าซในของเหลวและการซึมผ่านเยื่อบุถุงลม แต่จะแปรผกผันกับน้ำหนักโมเลกุล
(ขนาดโมเลกุล) ของสาร
ดังสูตร
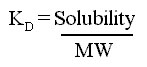 ค่า diffusion coefficient
จะแสดงในรูปของค่าความสัมพันธ์ โดยจะเทียบกับค่า KD ของออกซิเจน
ค่า diffusion coefficient
จะแสดงในรูปของค่าความสัมพันธ์ โดยจะเทียบกับค่า KD ของออกซิเจน
โดยทั่วไปเวลาที่ก๊าซ
O2 แพร่จากถุงลมเข้าสู่เลือด หรือ CO2
แพร่จากเลือดสู่ถุงลมจะใช้
เวลาเพียง 0.25 วินาที ขณะที่คนปกติขณะพัก (หัวใจเต้นประมาณ 80 ครั้ง/นาที
เวลาที่เลือดผ่าน pulmonary capillary จะประมาณ 0.75 วินาที
จึงเป็นเวลาที่เกินพอที่จะมีการแลกเปลี่ยนก๊าซ
จนเสร็จสมบูรณ์ ในคนหนุ่มปกติขณะพักจะมีค่า diffusing capacity
สำหรับ O2 ประมาณ 21 ml/min/mmHg Diffusing capacity
ของ CO2 ประมาณ 400-450 ml/min/mmHg และ
diffusing capacity ของ CO2 ประมาณ 17 ml/min/mmHg
ปกติ O2
ละลายได้ในพลาสมาประมาณ 0.3 มล. ต่อพลาสมา 100 มล. ซึ่งนเวลา 1 นาที
ที่เลือดผ่านปอด จะได้ O2 ประมาณ9-10 มล. เท่านั้น
(ในขณะที่ปกติขณะพัก ร่างกายมีความ
ต้องการ O2 เพื่อใช้ในการดำรงชีวิตประมาณ 210-250 มล.
ต่อนาที) แต่ในเลือดของคนและ
สัตว์ จะมีสารฮีโมโกลบินซึ่งอยู่ในเม็ดเลือดแดง โดยสารนี้จะมีความสามารถจับกับ
O2 ได้ดีกว่า
ได้ดีกว่าการละลายของ O2 ประมาณ 50-60 เท่า โดยสรุปพบว่าฮีโมโกลบิน
1 กรัม สามารถจับ
กับ O2 ได้ 1.34 มล. ใน 100 % O2 แต่เลือดดำที่เข้ามาใน
pulmonary capillaries มีค่า O2 saturation
ประมาณ 75 % โดยปกติในเลือด 100 มล. จะมีประมาณของฮีโมโกลบินประมาณ
15 กรัม ดังนั้นในเลือดดำที่มาจากห้องหัวใจด้านขวา จะมีปริมาณ O2
(O2
contnet ประมาณ
1.34 x 15 x 0.975 = 19.6 ml
แสดงว่าเมื่อเลือด 100 มล. ผ่านปอด จะได้รับ O2 เพิ่มขึ้น
ประมาณ 4.5 ml. โดยปกติร่างกายขณะพัก (ผู้ใหญ่) จะมีเลือดมาที่ปอด
ประมาณ 5000 มล.
ต่อนาที ดังนั้นใน 1 นาที ร่างกายจะได้รับ O2
จากการหายใจประมาณ 225 ml ซึ่งเพียงพอต่อ
ความต้องการใช้ O2 ของร่างกายขณะพัก
หลังจากเลือดแดง (เลือดที่ผ่านปอดแล้ว)
เมื่อไปเลี้ยงเนื้อเยื่อต่างๆ ในร่างกายจะมีการปล่อย
O2 ให้แก่เซลล์และนำ CO2 เข้ามาเพื่อที่จะนำไปขจัดออกจากร่างกายที่ปอด
CO2 ในเลือด
ประมาณ 7 % จะอยู่ในรูปของการละลายกับพลาสมา 23 % จะจับกับ hemoglobin
(carbaminolumoglobin) ที่เหลืออีก 70 % จะทำปฏิกิริยากับน้ำ แล้วอยู่ในรูปของ
HCO3- โดย
อาศัย enz. carbonic anhydrase ปฏิกิริยาเหล่านี้เป็นปฏิกิริยา
reversible เมื่อเลือดมาที่ปอด
CO2 ที่ละลายน้ำก็จะแพร่ผ่านตามความแตกต่างของความดัน
ความดันฮีโมโกลบินจะปล่อย
CO2 เพื่อจับกับ O2 แทน และ
HCO3- ก็จะรวมตัวกับ H+ ทำปฏิกิริยาจนได้เป็น
(และ H2O)
แล้วจึงแพร่ออกสู่ alveoli ต่อไป ปกติ PCO2
ในเลือดดำจะเท่ากับ 45 มม.ปรอทพบว่าเมื่อผ่าน
ปอดแล้วจะเหลือ PCO2 ในเลือดแดงเท่ากับ 40 มม.ปรอท
เมื่อเลือดผ่านปอด 100 มล. จะ
สามารถขับ CO2 ออกได้ประมาณ 4 มล. ดังนั้นใน 1 นาที ร่างกายจะขับ
CO2 ได้ประมาณ 200 มล.
ในคนปกติ (ผู้ใหญ่) ทั่วไปจะมีอัตราการหายใจประมาณ
12 ครั้ง/นาที ปริมาณของอากาศ
ในการหายใจเข้า-ออก แต่ละครั้งประมาณ 500 มล. (tidal volume)
ค่าปริมาตร dead space
= 150 ml. ดังนั้น alveolar มีค่าเท่ากับ (500-150)
x 12 = 4200 มล./นาที ในคนปกติจะมี
เลือดที่มาเลี้ยงที่ปอดประมาณ 5000 มล./นาที (เท่ากับปริมาตรของ
cardias output) ดังนั้นค่า
ventilation-purfusion ratio (V/Q) = 0.84
ในคนปกติที่อยู่ในท่ายืน
เนื่องจากผลของแรงโน้มถ่วง จะมีผลทำให้เลือดแพร่ผ่านปิดส่วน
บนได้น้อยกว่า โดยเฉพาะยอดของเนื้อปอด พบว่ามีค่าของ V/Q
สูงกว่าปกติมาก (ประมาณ 3
เท่าของค่าปกติ) แสดงว่าอากาศในถุงลมบริเวณนี้ บางส่วนไม่ได้มีการแลกเปลี่ยนก๊าซกับเลือด
(เกิด alveolar dead space) กล่าวได้ว่า
บริเวณส่วนของปอดส่วนนี้มี physiologic dead
space มากกว่าส่วนอื่น (physiologic dead space) กล่าวได้ว่า
บริเวณส่วนของปอดส่วนนี้
มี physiologic dead space มากกว่าส่วนอื่น (physiologic
dead space = anatomicald
space + alveolar dead space) ส่วนบริเวณส่วนล่างของเนื้อปอด
พบว่ามีเลือดไปเลี้ยงได้
มากกว่า จึงมีผลทำให้ค่า V/Q มีค่าต่ำกว่าปกติ (ประมาณ 0.6)
แสดงว่าจะมีเลือดบางส่วน
ทีไม่ได้ผ่านการแลกเปลี่ยน O2 (shunt) กล่าวได้ว่าบริเวณส่วนล่างของปอดมี
shunt effect
มากกว่าส่วนอื่นๆ ปรากฏการณ์นี้ถ้าอยู่ในท่านอนจะไม่เกิดขึ้น
"Physiologic shunt"
โดยทั่วไป 98 % ของเลือดที่เข้าสู่ left atrium จะผ่านมาจาก
pulmonary capillaries ในปอดซึ่งจะผ่านขบวนการแลกเปลี่ยน
O2 และ CO2 แล้ว (PO2
ประมาณ 104 มม.ปรอท) ส่วนอีก 2 % ที่เหลือเป็นเลือดดำที่มาจาก
bronchail capillaries
การที่มีเลือดบางส่วนที่ไม่ได้ผ่านการแลกเปลี่ยนก๊าซ ทำให้ค่า PO2
ในหัวใจด้านซ้ายลดต่ำลง
เหลือประมาณ 95-100 มม.ปรอท
ที่กล่าวมาแล้วนั้นเป็นค่า
variation ของ V/Q ratio ในคนปกติ ในโรคปอดเช่น โรคถุงลม
โป่งพอง (emphysema) อันมีสาเหตุมาจากการสูบบุหรี่ ซึ่งเป็นโรคที่มีการทำลายของ
V/Q ทั้ง
shunt effect และ dead space effect กล่าวคือเมื่อ
bronchioles ถูกทำลายจนมีการอุดตัน
ของท่อทางเดินหายใจ จะมีผลทำให้ส่วน alveoli ที่อยู่ต่ำลงไป
ไม่มีการระบายอากาศ แต่ยังมี
เลือดไหลผ่าน capillaries อยู่ทำให้ V/Q ต่ำมากหรือเท่ากับ
0 (shunt effect) เพราะเลือดที่
ผ่าน alveoli นี้ไม่มีการแลกเปลี่ยนก๊าซเลย
ในบางส่วนของปอดก็จะมีพยาธิสภาพที่ทำลายเฉพาะผนัง
alveoli มีผลทำให้เลือดผ่าน
ไปใน pulmonary capillary ไม่ได้ แต่ alveoli
ยังมีการระบายอากาศอยู่ แต่อากาศใน alveoli
ก็ไม่มีขบวนการแลกเปลี่ยนก๊าซ (dead space effect) ค่า
V/Q ก็จะสูงมาก เป็นต้น ซึ่งไม่ว่า
จะเป็นผลของ shunt effectหรือ dead space effect ที่ผิดปกติไปมากๆ
ก็จะมีผลต่อการแลก
เปลี่ยนก๊าซทั้งสิ้น
สำหรับ pH นั้นไม่ใช่ blood
gases แต่เกี่ยวข้องกับ blood gases ค่อนข้างมากทางคลินิก
เมื่อเจาะเลือดหา blood gases จะต้องหา pH ด้วย ทั้งนี้เพื่อช้ช่วยการวินิจฉัยแยก
acidosis,
alkalosis ชนิด metabolic ออกจากชนิด respiratory
pH ในเลือด (arterial
blood) จะอยู่ระหว่าง 7.4 + 0.05 ส่วนใน venous blood จะมี
ความเป็นกรดมากกว่า arterial blood ถ้าค่า = 7.4
จะมี [H+] เท่ากับ 40 nanomole/litre วิธีคำนวณหา
[H+] ง่ายๆ สำหรับช่วง pH 7.5-7.1 ซึ่ง
[H+] อยู่ระหว่าง 30-70 nmol/litre
คือถ้า pH เปลี่ยนจาก 7.4 ไป 0.01 unit [H+] จะเปลี่ยนจาก
40 nmole/litre ไป
1 nmolelitre เช่นกัน
pH ใน venous blood จะต่ำกว่า
arterial blood 0.03 unit ดังนั้น [H+] concentration
ใน venous blood จะมากกว่าใน arterial blood 3 nmole/litre ถ้า
pH ในเลือดจาก arterial
blood < 7.35 หรือ >7.45 จะเกิดภาวะที่เรียกว่า
acidosis และ alkalosis ตามลำดับ pH
ที่ถือว่ายัง compatible with life อยู่ระหว่าง 7.8-6.8 ส่วน
intracellular pH จะแปรตามชนิด
ของเซลล์ เช่น ในเม็ดเลือดแดง pH 7.2 ส่วนเซลล์กล้ามเนื้ออาจต่ำถึง
pH = 6.0 ได้
กลไกการควบคุม acid-base โดยระบบ buffer
แหล่ง H+ ion
ในร่างกายได้จากเมตาบอลิสมของคาร์โบไฮเดรท ไขมัน โปรตีน และกรด
นิวคลิอิค จะให้ทั้ง H+ และ CO2
ออกมา ส่วน H+ จะเข้าไปใน electron transport
chain
และถูก oxidized ด้วย O2 จากอากาศจนกลายเป็นน้ำ
ในคนปกติที่มี O2 supply เพียงพอ H+
ส่วนนี้จะไม่ส่งผลต่อการเปลี่ยน pH ในพลาสมาหรือเลือด แต่ถ้า
O2 supply ไม่พอ H+
ส่วนนี้จะทำให้เกิด acidosis ในเนื้อเยื่อเฉพาะที่ได้
กรดที่เกิดขึ้นในร่างกายอาจแบ่งเป็น 2
ประเภท ได้แก่ volatile acid และ non volatile
acid, volatile acid ได้แก่ H2CO3
ซึ่งมา
จาก CO2 ที่เกิดขึ้นจากการเผาผลาญคาร์โบไฮเดรท
ไขมัน โปรตีน และกรดนิวคลิอิค CO2
เกิดขึ้นวันละ 14,400 meq/day หรือ 10 mmol/min (1 meq/L
= 1 mmol/L สำหรับ
monovalent ions เช่น Na+, K+, Cl- และ HCO3
แต่ถ้าเป็น polyvalent ions 1 meq/L
x valency = mmol/L) CO2 ที่เกิดขึ้นแม้ไม่ใช้
acid แต่ในการขนส่ง CO2 จากเนื้อเยื่อ
CO2
ทำปฏิกิริยากับ H2O โดย carbonic anhydrase
จะได้ H2CO3 ซึ่งแม้จะเป็นกรดอ่อนแต่
แตกตัวได้ใน pH 7.4 ให้ H+ ในอัตรา
10 mmol/min และ HCO3- อีก 10 mmol/min
ซึ่ง
H+ ที่เกิดขึ้นนั้น จะถูกกำจัดโดย 2 กลไก
ขับออกในรูปของ CO2
โดยที่ H+ จะรวมตัวกับ HCO3-
ที่ปอดให้ H2CO3 ซึ่งเป็น volatile
acid และถูกขับออกทางลมหายใจ
ข. H+ จะถูก buffered โดย
buffering system ในร่างกาย
จากการครองธาตุ (metabolism) ของ
macromolecules และปฏิกิริยาทางเคมีที่เกิดใน
เซลล์จะได้กรดอีกประเภทหนึ่งที่เรียกว่า non volatile acid
หรืออาจเรียกอีกว่า endogenous
acid production (EAP) เกิดขึ้นประมาณ 1 mmol/Kg ของน้ำหนักตัวนผุ้ใหญ่
ส่วนใหญ่เป็น
กรดที่แก่กว่า carbonic acid ดังนั้นจะแตกตัวให้
[H+] มาก แบ่งเป็น organic acid เช่น
lactic acid จากการเผาผลาญคาร์โบไฮเดรท, acetoacetic
acid และ b-hydroxybutyric
acid จากเมตาบอลิสมของไขมัน และ inorganic acid เช่น
sulfuric acid จาก
S-containing amino acids แต่ส่วนใหญ่ของกรดอินทรีย์ เหล่านี้จะเป็น
intermediates ซึ่ง
ในที่สุดถูก oxidized เป็น CO2 และ
H2O จึงไม่เกิดการสะสม [H+]
ในคนปกติ นอกจาก
H2SO4 และ H3PO4
เท่านั้น ซึ่งเมื่อเกิดขึ้นจะต้องถูกกำจัดออกจากร่างกายโดยอาศัยไต
ปริมาณของ [H+] ที่ถูกกำจัดออกโดยไตอยู่ระหว่าง
50-100 meq/day และเปลี่ยนแปลงตาม
ปริมาณอาหารโปรตีนที่กินเข้าไป
การที่ร่างกายต้องควบคุม [H+]
หรือ pH ในร่างกายห้คงที่ระหว่าง 7.4 + 0.05 นั้น
ส่วน
หนึ่งเนื่องจากคุณสมบัติของ H+ ion ที่เป็น
highty reactive ions ทำให้ปฏิกิริยาระหว่าง H+
ion กับ negatively charged ส่วนอื่นของโมเลกุล เช่น
โปรตีน เกิดขึ้นรุนแรงจนอาจสะเทือน
conformation ของโปรตีนได้ และมาตรการแรกในการควบคุม
[H+] คือ buffer systems
ซึ่งในร่างกายคนมี buffer system สำคัญ 4 ระบบ ได้แก่
1. Hemoglobin และ plasma proteins
เนื่องจากโปรตีนในพลาสมา รวมทั้งโปรตีนอื่นๆ
ในเซลล์ประกอบด้วย amino acid ซึ่งเป็น
zwitterion และทั้ง carboxyl group กับ amino
group สามารถแตกตัวได้ที่ pH ต่างๆ กัน
ดังนั้นจึงทำให้โปรตีนเป็น
buffer ที่ดี โดยโปรตีนที่มีอยู่ใน 1 ลิตร ของพลาสมาสามารถจับ
proton ได้ 4.24 mEq
สำหรับฮีโมโกลบินซึ่งเป็นโปรตีนหลักในเม็ดเลือดแดง
และมีอยู่ในร่างกายถึง 15 gm % นั้น
ส่วน imidazole groups ของ histidine residues จะแตกตัวได้
พบว่า imidazole group ของ
deoxyhemoglobin จะแตกตัวได้น้อยกว่า oxyhemoglobin
ดังนั้น deoxyhemoglobin
จึงเป็น weaker acid กว่า oxyhemoglobin อันนี้เป็นระบบที่เหมาะสมเนื่องจากเมื่อ
HbO2
(oxyhemoglobin) ไปถึงเนื้อเยื่อ โดยที่มี H+
สูงในเนื้อเยื่อ ฮีโมโกลบินจะจับกับ H+ และปล่อย
O2 (Bohr effect) ซึ่งอาจเขียนในรูปสมการ
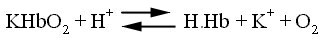
ซึ่งจะเห็นว่าที่ pH = 7.4
หรือในการรักษาให้ pH คงที่เท่ากับ 7.4 นั้น ขณะที่มีการเปลี่ยน
K.HBO2 H.Hb นั้น จะสามารถเติม H+
จำนวนหนึ่งโดย pH คงที่ ดังนั้นถึงแม้ว่าในช่วง pH
ระหว่าง 7.0-7.7 ฮีโมโกลบินจะมีส่วนใน
buffering capacity ไม่มากก็ตามแต่จากการที่
ฮีโมโกลบินมีปริมาณสูงในเม็ดโลหิตแดง และ 1 โมเลกุลยังมีถึง 38 histidine
จึงทำให้
ฮีโมโกลบินมี buffering capacity เป็น 6 เท่าของโปรตีนและเป็น
buffer system ที่สำคัญ
รองจาก HCO3/H2CO3 system
2. Bicarbonate-carbonic acid system (HCO3-/H2CO3)
Bicarbonate-carbonic acid system
เป็น buffering system ที่สำคัญที่สุดในร่างกาย
H2CO3 นั้นสามารถจะเพิ่มหรือลดได้ทันที
โดยอาศัยการทำงานของระบบหายใจนั่นคือเมื่อ
ต้องการลด H2CO3 ในเลือดทำได้โดยเพิ่ม
ventilation และถ้าต้องการเพิ่ม H2CO3
ก็ลด
การทำงานของปอดลง เป็นต้น และในขณะสมดุลย์จะมีลักษณะ
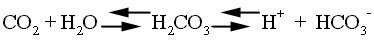
CO2 + H2O
จะเกิดขึ้นเร็วมากในเม็ดเลือดแดงและใน renal tubular cell เมื่อเกิดขึ้นแล้ว
H2CO3 จะสลายเป็น H+
+ HCO3-, HCO3-
จะ shift ออกสู่พลาสมาทำให้ Cl- ต้องเข้า
เซลล์และปฏิกิริยาจะ reverse ที่ปอดเมื่อ CO2
ถูกขับ และ pH ของเลือดจะขึ้นอยู่กับอัตรา
ส่วนของ HCO3-/H2CO3
ดังเห็นได้จาก Henderson Hasselbach equation ในปกติ pH
พลาสมา = 7.4; ratio ของ [HCO3-] :
[H2CO3] เป็น 20 : 1 เสมอ
ดังนั้นถ้าความเข้มข้น
ของ H2CO3 ใน arterial blood
= 1.2 mmol/litre (pCO2 = 40 mmHg) จะต้องมี HCO3-
concentration เท่ากับ 24 mmol/litre และพบว่าอัตราส่วนของ
[HCO3-] / [H2CO3]
ใน
venous blood จะลดลงจาก 20 : 1 เล็กน้อย เนื่องจากใน venous
blood มี PCO2 เพิ่มขึ้น
3. Phosphate buffer system
Phosphate buffering system (HPO4-2/H2PO4-1)
เป็น buffer system ซึ่งถือเป็น
องค์ประกอบส่วนน้อยในเลือดและพลาสมา แต่มีความสำคัญในการขับ H+
ออกโดยไต
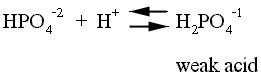
เนื่องจากใน pH ของเลือดซึ่งเท่ากับ
7.4 นั้น phosphate จะอยู่ในรูป HPO4-2
ถึง 80 % แต่ใน renal tubular lumen ซึ่งมีการขับ
H+ จะจับกับ HPO4-2 เป็น
H2PO4-1 และถูกขับ
ออกมาในปัสสาวะ ดังนั้นถ้าปัสสาวะมีฤทธิ์เป็นกรดจะพบ
phosphate ในรูป H2PO-1 เป็น
ส่วนใหญ่
การควบคุม acid-base โดยระบบหายใจ
เนื่องจาก H2CO3
เป็น volatile acid การควบคุมสภาพความเป็นกรดด่างในร่างกาย
โดยระบบหายใจ กระทำผ่านการควบคุม pCO2 ในเลือดโดย alveolar ventilation ถ้า
alveolar
ventilation ลดน้อยลง เช่นหายใจช้า หายใจตื้น จะทำให้การแลกเปลี่ยนก๊าซลดน้อยลง
ดังนั้น
pCO2 ในเลือดจะสูงขึ้น pH จะลดลง หรืออาจกล่าวได้อีกนัยหนึ่งว่า
hypoventilation จะทำให้
เกิด respiratory acidosis ส่วน hyperventilation
ให้ผลตรงข้าม เมื่อ CO2 ถูกขับออกมา
จะทำให้ pH สูงขึ้น เกิดภาวะ respiratory alkalosis
ได้ อธิบายได้ผ่านทาง Henderson
Hasselbach equation ดังได้กล่าวแล้ว
การควบคุม acid-base โดยระบบไต
ไตทำหน้าที่ขับ non
volatile acid ซึ่งได้จากกระบวนการการเมตาบอลิสม ในร่างกายออก
ทางปัสสาวะได้วันละ 50-80 meq H+/day
แต่ไตจะปรับตัวต่อการเปลี่ยนแปลง ของสภาวะ
กรดด่าง ในร่างกายได้ช้ามาก เช่น ถ้าเกิดมีกรดเกินปกติ (acidosis)
ไตต้องใช้เวลาหลายวันกว่า
จะปรับให้เพิ่มการขับกรดออก แต่เมื่อเพิ่มแล้วอาจจะขับได้ 400
meq H+/day ในทางตรงกัน
ข้ามถ้ามีเบสเกินปกติก็อาจขับ HCO3-
ได้ถึง 200 meq H+/day |