| คุณสมบัติ Peptide-binding ของ HLA โมเลกุล |
|
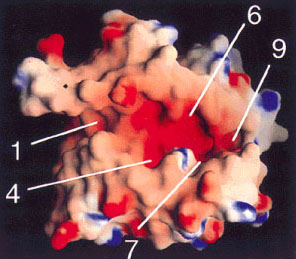
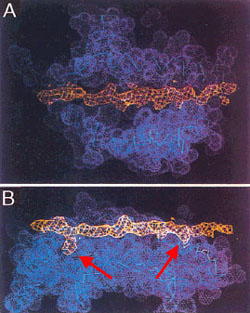
peptide binding cleft มีลักษณะเป็น pocket ที่ประกอบขึ้นจากการรวมตัวของกลุ่ม amino acid ที่อยู่บน beta-pleated sheet หรือ alpha helix ของ HLA molecule แต่ละ pocket ใหญ่ๆ ที่สำคัญจะตรงกับ side chain ของ peptide ตำแหน่งที่ 1, 4, 6, 7, และ 9 ดังแสดงในรูป |
|
ภาพ
peptide binding cleft ของ HLA molecule พร้อม peptide ที่อยู่ในร่อง |
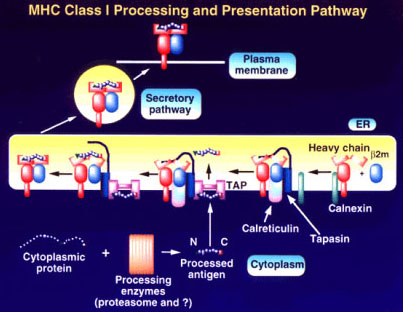
| รูปที่
8 แผนภูมิแสดง
Processing และ Presentation pathway ของ HLA class I molecule |
 |
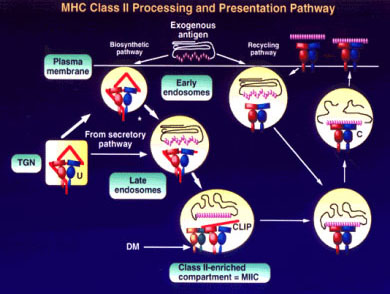
| รูปที่
9
แผนภูมิแสดง Processing และ Presentation pathway ของ HLA class II molecule |
 |